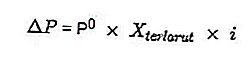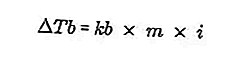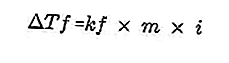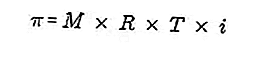Cerchi di prestare attenzione a ciò che ci circonda legato alla chimica? La più semplice è l'aria che respiriamo, che contiene una miscela di ossigeno, azoto e altri gas. Condimenti, coloranti e conservanti sono anche altri esempi di sostanze chimiche che ci circondano. La chimica è una branca delle scienze naturali che studierai a scuola che studia vari materiali, un esempio è la struttura della materia, le proprietà della materia, la forma del materiale, i cambiamenti nella materia, la classificazione della materia, la composizione della materia e l'energia che accompagnano questi cambiamenti. Non solo matematica e fisica, la chimica ha anche vari tipi di formule, sai. Ci sono molte formule chimiche da cui imparerai, dalle proprietà colligative alle reazioni redox.
In questa occasione impareremo varie formule chimiche e anche esempi di problemi che ti aiuteranno a comprendere i concetti di formule chimiche.
Formule chimiche e problemi di esempio
La presenza di formule in chimica serve ad aiutare i ricercatori a trovare vari tipi di risultati sperimentali da realizzare. Per essere in grado di padroneggiare bene questa scienza, devi conoscere alcune formule chimiche che incontrerai spesso quando studi chimica.
Formula per proprietà colligative delle soluzioni
Le proprietà colligative di una soluzione sono una natura di una soluzione che non dipende da un tipo di sostanza solubile ma dipende solo dalla concentrazione delle particelle nella soluzione. Quindi la natura colligativa della soluzione consiste di due tipi di proprietà, vale a dire la natura colligativa della soluzione elettrolitica e la natura colligativa della soluzione non elettrolitica.
- Proprietà colligative di soluzioni non elettrolitiche
Sebbene la natura colligativa implichi una soluzione, la natura colligativa non dipende dall'interazione delle molecole di soluto e soluto, ma dalla quantità di soluto disciolto in una soluzione. Le proprietà colligative consistono in una diminuzione della pressione del vapore, aumento del punto di ebollizione, diminuzione del punto di congelamento e pressione osmotica. Ognuno richiede una formula chimica per ottenere il risultato.
- Equazione della caduta di pressione del vapore

Fonte: formula.co.id
- Equazione di aumento del punto di ebollizione
Il punto di ebollizione di un liquido è la temperatura fissa alla quale bolle. A questa temperatura, la tensione di vapore del liquido ha un'equazione nella pressione dell'aria circostante ed è causata dall'evaporazione di tutte le parti del liquido. Il punto di ebollizione di un liquido può essere misurato con una pressione di 1 atmosfera.
La differenza tra il punto di ebollizione di una soluzione e il punto di ebollizione di un solvente puro è chiamata aumento del punto di ebollizione, l'equazione per l'aumento del punto di ebollizione è:

Fonte: formula.co.id
- Equazione di derivazione del punto di congelamento
Un soluto presente in soluzione renderà il punto di congelamento della soluzione più piccolo del punto di congelamento del solvente. Equazione di riduzione del punto di congelamento:

Fonte: formula.co.id
- Pressione osmotica
La pressione osmotica è una forza richiesta per bilanciare la pressione del solvente dalla membrana semipermabile attraverso la soluzione.
Una membrana semipermeabile è una membrana attraverso la quale possono passare le molecole di solvente, ma i soluti non possono passare. Secondo Van't Hoff, alla pressione osmotica la soluzione è formulata come segue:

Fonte: formula.co.id
- Proprietà colligative delle soluzioni elettrolitiche
Nella concentrazione, le proprietà colligative della stessa soluzione elettrolitica hanno un valore maggiore se confrontate con le proprietà colligative della soluzione non elettrolitica. Perché il gran numero di particelle di soluto risulta dalla reazione di ionizzazione della soluzione elettrolitica che è stata formulata nel fattore di Van't Hoff.
Il calcolo delle proprietà colligative delle soluzioni elettrolitiche sarà sempre moltiplicato per il fattore Van't Hoff come segue:

Fonte: formula.co.id
Alcune delle formule per le proprietà colligative di altre soluzioni elettrolitiche sono:
- Calo della pressione del vapore
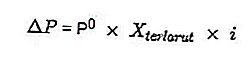
Fonte: formula.co.id
- Aumento del punto di ebollizione
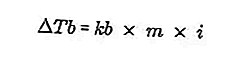
Fonte: formula.co.id
- Abbassamento del punto di congelamento
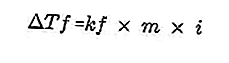
Fonte: formula.co.id
- Pressione osmotica
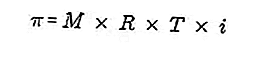
Fonte: formula.co.id
Formule di molalità, molalità e frazione molare
Molarità (M)
La molalità è il numero di moli di una sostanza disciolta in 1 litro di soluzione.

Fonte: formula.co.id
M = molarità
Mr = massa molare del soluto (g / mol)
V = volume della soluzione
Molalità (m)
La molalità è il numero di moli della sostanza disciolta in 1 kg di solvente. La formula chimica è la seguente.

Fonte: formula.co.id
m = molalità (mol / kg)
Mr = massa molare del soluto (g / mol)
massa = massa del soluto (g)
P = massa di solvente (g)
Frazione mol
La frazione molare è un'unità di concentrazione in cui tutti i componenti della soluzione sono calcolati in base alle moli.

Fonte: formula.co.id
xi = numero di moli
i, j, xj = frazione molare
Esempi di problemi di formula chimica
1. Se la pressione osmotica di 500 ml di soluzione di fruttosio, C6H12O6 da 32 ° C è di 2 atm, la quantità di massa di fruttosio disciolta è?
Soluzione:

2. Nella frazione molare della soluzione di urea in acqua 0,2. La pressione del vapore saturo dell'acqua pura con una temperatura di 20 ° C è 17,5 mmHg. Quindi alla soluzione la pressione del vapore saturo alla temperatura seguente è?
X urea + X acqua = 1
0,2 + X acqua = 1
X acqua = 0,8
P soluzione = X acqua x P acqua
P della soluzione = 0,8 x 17,5 mmHg
P della soluzione = 14 mmHg
Queste sono alcune formule chimiche che puoi imparare per rendere più facile rispondere a vari tipi di domande di chimica. Se ritieni che queste formule non siano sufficienti, puoi provare il prodotto PROBLEMA, una soluzione di pratica online ponderata e completa per la Classe Smart come Trigonometria, Limite, Logaritmo e molti altri. A partire dalle elementari, dalle medie alle superiori con varie materie come matematica, fisica, chimica e altre. Qui puoi imparare vari tipi di formule complete di esempi del problema.
Dai, cosa stai aspettando! Proviamo subito gli esercizi PROBLEMA in Smart Class.